辉瑞公司的口服Janus激酶1(JAK1)抑制剂abrocitinib在第二项III期研究中达到了其主要终点,该研究在12岁及以上的中度至重度特应性皮炎患者中进行。辉瑞公司(Pfizer)宣布了五月份第一项试验的正面收益。
JADE MONO-2是一项随机,双盲,安慰剂对照的平行组研究,旨在评估12周内每天一次00 mg和200 mg剂量的阿布替尼单药治疗的有效性和安全性stylechina.com。辉瑞表示,与较早的JADE MONO-1试验一致,结果显示,到第12周时,无论采用哪种剂量的阿布替尼,达到每个共同主要疗效终点和每个主要次要终点的患者百分比均显着高于安慰剂。另外,统计学上显着数量的患者在第二周时瘙痒减轻,这是通过瘙痒症数字评分量表测得的瘙痒严重程度降低了四分以上。JADE MONO-1和JADE MONO-2试验的全部数据将在下个月的欧洲科学会议上发表。
辉瑞公司炎症和免疫学首席开发官迈克尔·科博说,JADE MONO-2试验的发现增加了越来越多的证据,证明阿布替尼具有改善特应性皮炎患者生活的潜力。
“我们期待JADE计划的继续发现,以及使用主动对照的下一次阿布西替尼疗效研究的结果,该结果将于2020年春季面世。这将进一步加深我们对阿布西替尼作为该慢性病患者的潜在药物的了解条件。” Corbo在一份声明中说。
阿布罗替尼是一种选择性抑制Janus激酶(JAK)1的口服小分子。抑制JAK1被认为可调节参与AD病理生理的多种细胞因子,包括白介素(IL)-4,IL-13,IL-31和干扰素γ。 。JAK途径与炎性过程相关,并且涉及超过50种细胞因子和生长因子的信号传导。阿布西替尼于2018年2月获得美国食品和药物管理局的突破性治疗称号,用于治疗中度至重度特应性皮炎患者。
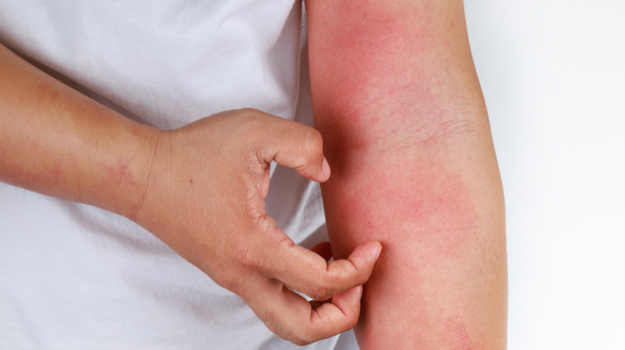
特应性皮炎是一种慢性皮肤病,其特征是皮肤发炎和皮肤屏障缺陷。特应性皮炎的特征是发红,发痒,硬结和渗出。它是最常见的慢性复发性儿童皮肤病之一,在全球范围内影响着多达10%的成年人和20%的儿童。
对于JADE MONO-2试验,该试验中共有391名受试者被随机分配接受阿布西替尼和安慰剂的剂量。根据基线疾病的严重程度和年龄对随机分组。JADE MONO-2的共同主要研究终点是获得调查者全球评估得分为清晰或几乎清晰的皮肤且两分或以上改善的患者比例;湿疹面积和严重性指数得分与基线相比至少达到75%或更高的患者比例。主要的次要终点是瘙痒严重程度降低四点或以上的患者比例。
安全性结果显示,两种剂量的阿布罗替尼均耐受良好,与JADE MONO-1大致一致。
