TACTI-002在与 MSD 合作进行的 PD-L1 全人群 II 期临床试验中达到了其用于第一线非小细胞肺癌 (NSCLC) 患者的主要目标( N=114)
efti 加 pembrolizumab 的组合显示出良好的抗肿瘤活性:
与 ASCO 2021 (N=36) 报告的数据相比,局部读数提高了 38.6%(意向治疗,44/114 名患者)和 42.7%(可评估患者,44/103)的总体反应率 (ORR)
在所有 PD-L1 状态组中观察到令人鼓舞的反应,包括那些 PD-L1 阴性 (TPS < 1%) 和 PD-L1 低 (TPS 1-49%) 表达肿瘤的患者,这些患者不太可能对抗 PD- 1 单药治疗
其他次要终点,包括疾病控制率 (DCR) 和中期无进展生存期中位数 (PFS),继续显示所有 PD-L1 表达水平的改善
安全且耐受性良好,其安全性与之前报道的派姆单抗单药治疗研究中观察到的一致
结果支持 efti 的持续后期临床开发
澳大利亚悉尼,2022 年 6 月 4 日 (GLOBE NEWSWIRE) -- Immutep Limited (ASX: IMM; NASDAQ: IMMP)(“Immutep”或“本公司”),一家开发新型 LAG-3 相关免疫疗法治疗癌症和自身免疫性疾病,宣布来自 II 期 TACTI-002 试验的第一线 NSCLC 患者(A 部分)的新数据,评估Immutep 的主要候选产品eftigimod alpha(“efti”或“IMP321”)与 MSD 的抗 PD-1 KEYTRUDA®(派姆单抗)治疗 114 名患者。
这些数据在美国临床肿瘤学会 (ASCO) 2022 年年会上以口头报告的形式呈现。
TACTI-002 首席研究员、西班牙Vall d'Hebron大学医院的Enriqueta Felip博士说: “看到 efti 加pembrolizumab的组合在一线 NSCLC患者中显示出良好的抗肿瘤活性,这是非常令人鼓舞的。这些反应是深刻而持久的,而且患者的停药率也很低。我相信 efti 加 pembrolizumab 的组合值得后期临床研究。”
Immutep 首席战略官和首席营销官 Frederic Triebel 博士指出: “我们的 ORR 在 1 st线 NSCLC 患者与抗 PD-1 单药治疗的历史结果相比,在 PD-L1 全人试验中的反应率通常约为 20%。我们特别高兴地看到所有 PD-L1 状态组的反应令人鼓舞,这表明即使在 PD-L1 无或低表达的患者中,efti 也可能启动抗肿瘤免疫反应。此外,efti 联合 pembrolizumab 的安全性与之前报道的 pembrolizumab 单药治疗研究中观察到的一致。我们仍然相信,efti 凭借其独特的作用机制,最终可能会为不同类型的癌症患者提供非常有意义的益处,包括那些治疗选择更有限的患者。”
Immutep 首席执行官 Marc Voigt 说: “我们很高兴 efti 加 pembrolizumab 在不同患者群体中的组合改善了患者的预后。这些数据对患者来说是令人鼓舞的,因为存在未满足的医疗需求,特别是对于那些没有或低 PD-L1 表达的非小细胞肺癌患者。我们扩大了这部分研究,以了解在一小部分患者中的早期结果是否适用于一百多名患者。按照生物技术标准,我们认为这是 II 期试验的大量患者群体。”
“对于 Immutep 而言,这些非常有利的结果具有战略意义,因为它们支持后期开发,以形成一个有吸引力且非常大的可寻址市场,”他说。
试验终点
根据 iRECIST 和本地读数,主要终点是 ORR。今天公布的数据代表了对该终点成熟数据的初步分析。次要终点包括 RECIST 1.1 的 ORR、DCR、反应持续时间 (DoR)、PFS、总生存期 (OS) 和安全性评估。
患者人群和病情在欧洲、美国和澳大利亚的 19 个试验地点的 6 个国家共招募
了 114名一线 NSCLC 患者并接受了efti加 pembrolizumab 治疗。
重要的是,患者入组时没有选择任何 PD-L1 状态(PD-L1 all-comers),这是一种表明对 pembrolizumab 有反应可能性的生物标志物。该试验被确认为“PD-L1 全员试验”,约 70% 的患者的肿瘤进展评分 (TPS) < 50%。93% 的患者在进入研究时患有转移性疾病,患者的 ECOG 体能状态为 0 (37.7%) 或 1 (62.3%)。研究开始前的治疗包括非转移性疾病的放疗(33%)、手术(20%)和全身治疗(22%)。该试验反映了该适应症的典型患者群体,包括鳞状/非鳞状疾病和男性/女性代表的混合。
TACTI -002 一线 NSCLC 患者的主要发现——数据截止日期2022年 4 月 15 日iRECIST对主要终点的初步分析——ORR
通过局部读数,意向治疗 (ITT) 组(44/114 名患者)的 ORR 为 38.6%,可评估患者(44/103)的 ORR 为 42.7%,见表 1
在这项全员试验中所有 PD-L1 状态组的反应(通过中心实验室评估):
PD-L1 阴性患者的 ORR 为 28.1% (9/32)
PD-L1 状态为 1-49% 的患者的 ORR 为 41.7% (15/36)
PD-L1状态≥1%的患者ORR为45.5% (25/55)
PD-L1 状态≥ 50% 的患者 ORR 为 52.6% (10/19)
鳞状 (35%) 或非鳞状 (38.9%) 肿瘤类型的 ORR 相当
RECIST 1.1 结果与 iRECIST 结果相当
与针对所有人群和 PD-L1 状态组的抗 PD-1 单一疗法的历史试验相比,ORR 是有利的1
表 1 – TACTI - 002 一线 NSCLC 患者的主要终点(ORR)结果
肿瘤反应2 | A部分第一 | |
ORR 根据iRECIST通过本地读取 | n (%) | [95% 置信区间] 3 |
ORR (ITT, N=114) | 44 (38.6%) | [29.6-48.2] |
ORR(可评估患者,N=103) | 44 (42.7%) | [33.0-52.9] |
iRECIST的分析– DCR、DoR和PFS
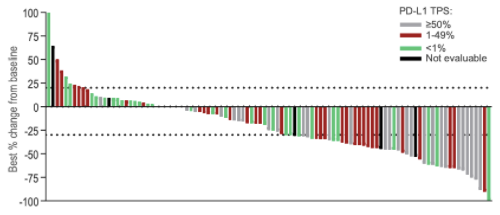
反应很深,见图表1
反应也很持久,只有 8.6% 的确认反应进展≤ 6 个月,中位 DoR 尚未达到
中期中位 PFS(ITT、PD-L1 所有患者)为 6.9 个月
≥ 1% PD-L1 状态组的中期中位 PFS 增加到 8.4 个月,≥ 50% PD-L1 状态组增加到 11.8 个月。与抗 PD-1 单一疗法的历史试验相比仍然有利4
可评估患者的 DCR (ITT) 为 73.7% (84/114) 和 81.6% (84/103)
DCR 在所有 PD-L1 状态组中具有可比性,范围为 68.8-79.0%
图1 –来自TACTI -002 的一线NSCLC患者的病变大小相对于基线的变化
安全
efti 加 pembrolizumab 的组合安全且耐受性良好,延续了 efti 迄今为止的良好安全性。A 部分报告了较低的停药率,只有 9.6% 的患者因研究治疗相关的不良事件而停药。除局部注射部位反应(红斑)外,迄今为止的安全性概况与先前报道的 pembrolizumab 单一疗法研究中观察到的一致。
结论efti
联合 pembrolizumab在 PD-L1 人群和所有 PD-L1 状态组的一线 NSCLC 中显示出良好的疗效,并且治疗中断率低。数据支持这一迹象的持续后期发展。
网络直播详情
公司将举办全球网络直播,讨论参与其 II 期 TACTI-002试验的一线非小细胞肺癌患者的新数据,包括分析师问答。
日期和时间:澳大利亚东部标准时间 上午 8 点(悉尼)2022 年 6 月 7 日星期二/
CDT 下午 5 点(芝加哥)2022 年 6 月 6 日星期一/欧洲中部
时间午夜 12 点(柏林)2022 年 6 月 7 日星期二
演讲者:Immutep 首席执行官 Marc Voigt,CMO/CSO Frederic 博士战略发展副总裁 Triebel 和 Christian Mueller
注册: https ://us02web.zoom.us/webinar/register/3616539572927/WN_fAVtcc30SXuBz-kBxfF86g
问题: 请投资者提前通过immutep@citadelmagnus.com提交问题。
活动结束后将在 www.immutep.com 上重播网络广播。
下一个结果
Immutep 预计将在 2022 年下半年报告 TACTI-002 的进一步结果。
关于 TACTI-002 试验
TACTI-002(两种活性免疫疗法)正在与美国新泽西州 Rahway 的默克公司(在美国和加拿大以外称为“MSD”)合作进行。该研究正在评估 eftilagimod alpha (efti) 与默沙东抗 PD-1 疗法 KEYTRUDA® (pembrolizumab) 的组合,用于一线和二线头颈部鳞状细胞癌或非小细胞肺癌患者。
该试验是一项 II 期,西蒙的两阶段、非比较、开放标签、单臂、多中心临床研究,正在澳大利亚、欧洲和美国的研究中心进行。
患者参与以下其中一项:
• A 部分 - 一线非小细胞肺癌 (NSCLC),PD-X 未接受过
• B 部分 - 二线 NSCLC,PD-X 难治
• C 部分 - 二线头颈部鳞状细胞癌细胞癌 (HNSCC),PD-X 幼稚
TACTI-002 是一项针对 PD-L1 状态的全面研究,PD-L1 是一种众所周知的预测标志物,可预测帕博利珠单抗单药治疗的反应,尤其是在 NSCLC 和 HNSCC 中。
有关该试验的更多信息,请访问 Immutep 的网站或 ClinicalTrials.gov(标识符:NCT03625323)。
关于 Immutep
Immutep 是一家全球活跃的生物技术公司,在开发用于治疗癌症和自身免疫性疾病的 LAG-3 相关免疫治疗产品方面处于领先地位。Immutep 致力于利用其技术和专业知识为患者带来创新的治疗选择,并为股东创造最大价值。
Immutep 目前的主要候选产品是 eftilagimod alpha(“efti”或“IMP321”),一种可溶性 LAG-3 融合蛋白 (LAG-3Ig),它是一种正在探索用于癌症的一流抗原呈递细胞 (APC) 激活剂和传染病。Immutep 还在开发一种用于自身免疫性疾病的 LAG-3 (IMP761) 激动剂。
Immutep 的大型制药合作伙伴正在开发其他 LAG-3 产品,包括用于免疫反应调节的抗体。
Immutep 在澳大利亚证券交易所 (IMM) 和美国纳斯达克 (IMMP) 上市。

